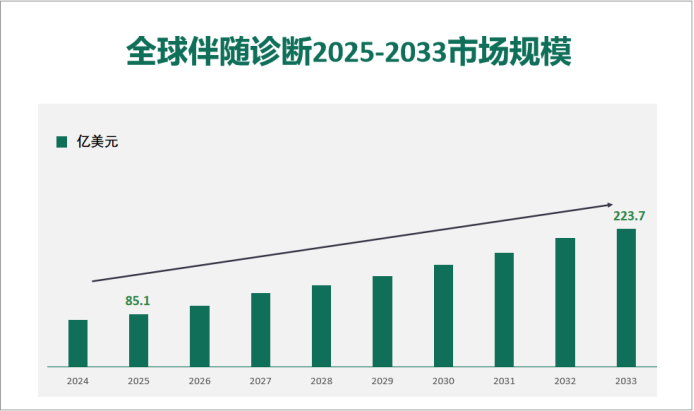
2025年全球伴随诊断2025年市场价值为85.1亿美元,预计到 2033 年将达到223.7亿美元。
伴随诊断是一种用于确保相应生物制品或药物安全有效应用的检测。这类检测通常用于癌症诊断。根据识别出的生物标志物,可以推荐合适的药物。这些检测可根据特定患者的反应提供个性化治疗。
按类型
根据类型,伴随诊断市场分为聚合酶链式反应、免疫组织化学、原位杂交、下一代基因测序等。
按应用
根据应用,伴随诊断市场分为制药和生物制药公司、参考实验室、合同研究组织。
伴随诊断市场区域洞察
日本:作为增长最快的亚太地区的一部分,日本市场正在因癌症发病率上升、医疗保健基础设施改善以及开发先进诊断产品的医疗器械公司数量不断增加而扩大。
美国:癌症发病率极高,推动了市场增长,预计 2022 年将报告 190 万例新发病例。美国市场也是创新的中心,FDA 不断批准新型检测方法,例如首个使用下一代测序 (NGS) 技术的液体活检伴随诊断。
中国:公司的增长得益于旨在在中国开发和商业化伴随诊断的战略合作伙伴关系。亚太地区每年新增癌症病例占全球的50%,这催生了对靶向治疗及其相关诊断测试的巨大需求。
欧洲:作为第二大市场,欧洲的增长得益于制药公司与伴随诊断制造商之间合作的增多。例如,为开发新型抗癌药物的血液伴随诊断测试而展开的合作,正在扩大该地区精准医疗的可及性。
市场驱动因素
癌症患病率上升促进市场增长
近年来,癌症发病率显著上升。癌症病例的不断增长增加了对有效伴随诊断 (CDx) 检测的需求,因为基因组检测可以清晰地了解患者的肿瘤情况,并为医生提供精准的治疗方案建议。因此,癌症发病率的不断上升也推动了伴随诊断 (CDx) 产品的销量。
根据美国癌症协会杂志发布的数据,预计2022年美国将报告190万例新发癌症病例。
此外,根据世界卫生组织(WHO)的数据,2022年全球新增乳腺癌病例226万例,新增肺癌病例221万例。
此外,为了满足日益增长的需求,人们正在开发新的测试来诊断特定类型的突变。
2020年8月,美国FDA批准了Guardant360 CDx。这款首个液体活检伴随诊断产品采用新一代测序(NGS)技术,用于识别转移性非小细胞肺癌(NSCLC)中表皮生长因子受体(EGFR)基因特定类型突变的患者。
此外,市场的主要参与者正在合作开发先进的肿瘤伴随诊断技术。
例如,2023年10月,QIAGEN与Myriad Genetics达成合作。此次合作旨在为制药公司提供创新服务和产品,并推进癌症伴随诊断解决方案。
这一因素导致了全球对这些测试的需求,并推动了预测期内市场的增长。
监管机构批准针对不同适应症的新检测,以刺激市场增长
伴随诊断行业正在见证大量新产品的批准。随着获批新产品数量的增加,多种检测方法也随之采用,从而促进了市场的增长。此外,主要制造商专注于开发新型检测方法,以促进伴随诊断市场的增长。例如,2022 年 5 月,Illumina 的 TruSight 肿瘤学 (TSO) 综合检测获得了 CE 批准。该试剂盒可评估多种肿瘤生物标志物,以识别癌症患者的特定分子图谱。此外,2022 年 5 月,安捷伦科技公司的 PD-L1 IHC 22C3 pharmDx(一种定性免疫组织化学检测方法)获得了批准。该检测方法用于识别宫颈癌患者,KEYTRUDA(抗 PD-1 疗法)可能是合适的治疗选择。
此外,监管机构对伴随诊断检测的监管批准不断增加,推动了市场的增长。
例如,2023年3月,美国食品药品监督管理局批准了一项新的伴随诊断检测方法VENTANA PD-L1 (SP263),用于识别可能接受cemiplimab治疗的II至IIIA期非小细胞肺癌(NSCLC)成年患者。因此,这些因素将有力地支持全球伴随诊断市场的增长。
制约因素
不完善的报销方案和严格的监管框架限制了市场增长
尽管伴随诊断测试的接受度不断提高,但目前仍缺乏标准化的报销标准,报销金额需根据具体情况确定。
例如,根据德国泰勒韦辛律师事务所(Taylor Wessing LLP)2022年6月发表的一篇文章,住院和门诊的报销有所不同。在住院治疗体系中,诊断费用主要由诊断相关群体承担。而对于门诊治疗,则根据具体的可报销服务目录进行报销。
此外,伴随诊断(CDx)缺乏标准的监管框架。伴随诊断(CDx)在制定治疗决策时,对灵敏度和特异性起着重要作用,其临床开发和监管面临诸多挑战。
欧盟目前正在实施体外诊断医疗器械法规(IVDR)。这项新法规对科学有效性和临床性能提出了一系列严格的要求。
根据Biomarker Insights 2021年在美国国家医学图书馆发表的一篇文章,伴随诊断(CDx)的合格评定过程必须经过医疗机构和公告机构之间的合格评定程序。咨询周期超过60天,可延长至60天。
此外,美国食品药品监督管理局宣布对传染病诊断设备和伴随诊断体外诊断(IVD)进行重新分类,制造商需要通过510(K)审批途径寻求上市授权。
一般来说,合适的报销政策和法规是推动设备普及的关键因素。因此,缺乏报销和严格的监管将阻碍该设备在全球的普及,从而阻碍预测期内市场的增长。

我们提供更专业明智的市场报告,让您的商务决策锦上添花。


400-166-9286
181-6370-6525

贝哲斯客服

