1.整体市场规模
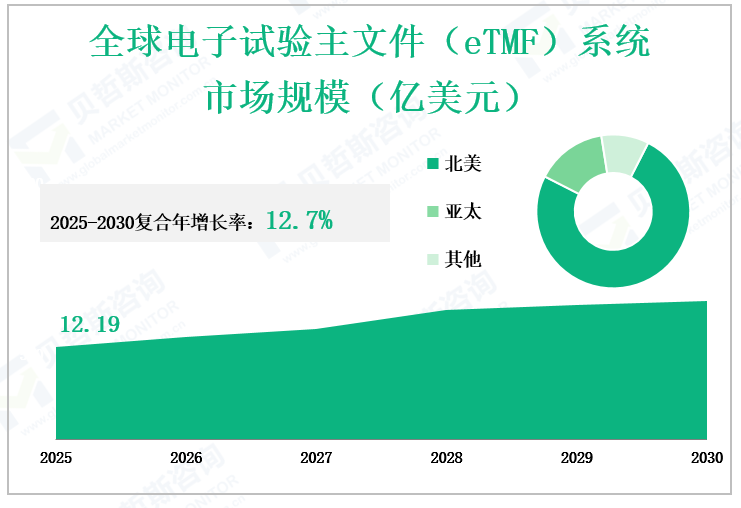
预计2025年全球电子试验主文件(eTMF)系统市场规模将达到12.19亿美元,2025——2030复合年增长率达12.7%。这一增速显著高于医药行业平均水平,反映出数字化转型在临床试验领域的迫切需求。市场扩张主要得益于eTMF系统渗透率提升、临床试验数量激增、生物制药企业与合同研究组织(CRO)合作深化,以及行业研发投入持续增长。例如,全球每年新增临床试验数量以8%-10%的速度递增,直接拉动eTMF系统的需求。
2.区域市场格局
北美主导:2014年北美市场占据最大份额,主要归因于美国政府对临床研究的高额资金支持、大量临床试验落地(占全球35%以上),以及Veeva Systems、Oracle等头部企业的本土优势。
亚太崛起:中国、日本及东南亚地区(RoAPAC)成为增长最快的市场,生物医药产业政策扶持(如中国“十四五”医药工业规划)、临床试验外包需求增加,以及疫苗研发热潮(如新冠疫苗临床试验推动)是核心驱动力。
3、未来趋势与机遇展望
AI与自动化:预计到2027年,90%的eTMF系统将集成AI功能,实现文档自动分类、缺失数据预警、合规性智能校验,将人工操作量减少50%以上。
数据整合与分析:eTMF系统与电子健康记录(EHR)、真实世界数据(RWD)平台的集成加速,例如通过患者穿戴设备数据自动填充临床试验报告,提升数据实时性。
新兴市场红利:中国、印度、巴西等国家临床试验数量年均增长25%,eTMF系统渗透率不足30%,未来五年有望成为增速最快的区域。例如,中国CDE(国家药监局药审中心)2023年发布《临床试验数据管理工作技术指南》,明确鼓励电子数据管理系统应用,直接推动市场需求。
政策合规驱动:全球主要监管机构(FDA、EMA、NMPA)逐步提高电子文档提交要求,例如FDA自2025年起强制要求部分临床试验提交eTMF文档,这将倒逼企业加速系统部署。
潜在风险提示
数据安全事件:若发生大规模数据泄露(如2023年某CRO公司eTMF系统遭黑客攻击,影响10万患者数据),可能引发行业信任危机,增加合规成本。
技术标准不统一:不同地区法规对eTMF系统的要求存在差异(如中国要求电子签名符合《电子签名法》,欧盟需遵循GCP附则),企业需投入额外资源进行适配,可能延缓市场渗透速度。
|
技术发展方向 |
AI与自动化 |
|
数据整合与分析 |
|
|
市场增长机遇 |
新兴市场红利 |
|
政策合规驱动 |
|
|
潜在风险提示 |
数据安全事件 |
|
技术标准不统一 |

我们提供更专业明智的市场报告,让您的商务决策锦上添花。


400-166-9286
181-6370-6525

贝哲斯客服

